GW
ジョージ・ワイズマン のリサーチ
(George Wiseman's research)
交流電源による水の電気分解
触媒(電解液)を用いずに交流電源で直接水を電気分解する。
120VAC
0.5A
276ml 脱イオン水 (De-ionized water)
120V交流を用いて0.5A (120 x 0.5 =60W) で276mlの脱イオン水を電気分解した。
結果
水温上昇
10分で30℃(20℃-50℃)
25分で74℃(20℃-94℃)
0.276kg x 1 x 30℃ = 8.28kcal
8.28kcal/10min(600sec) = 13.8cal/sec
1kcal = 4.187kJ
8.28kcal = 8.28 x 4.187kJ = 34.66836kJ
J = Ws
34.670kJ = W x 600sec
W = 34.670kJ/600 = 57.78W
同じ60W (120V x 0.5A) 電源でニクロム線で水を温めると、
20℃から50℃まで30℃温度を上げるために要した時間は20分、85℃まで65℃温度を上げるためには1時間弱かかる。
水の電気分解による水温の上昇の方が、ニクロム線ヒータより断然早い。
| 30℃上昇 | 70℃上昇 | |
|---|---|---|
| 電気分解 | 10分、 | 25分 |
| ヒーター | 20分、 | 1時間弱 |
交流電源による水の電気分解の水の温度の急上昇は、発生ガスがブラウンガス(HHOガス)でないことを示しています。
電解水が高温となると、H2、O2、水蒸気の混合ガスとなります。
それは、単一原子のHとOの「HHOガス」ではありません。
交流ではHHOガスの発生はありません。
交流120Vの高電圧による水の電気分解では、単一原子のHとOが発生したとしても、直ちに再結合し水に戻るために水温が高くなるとみなせます。
交流電源で直接水を電気分解すると電気エネルギーは熱に転換され水を沸騰させるだけとなります。発生する気体はHHOガスではなく水蒸気です。
直流電源による水の電気分解
電解液
電極プレート
直流電源用電流制御用キャパシター(コンデンサー)
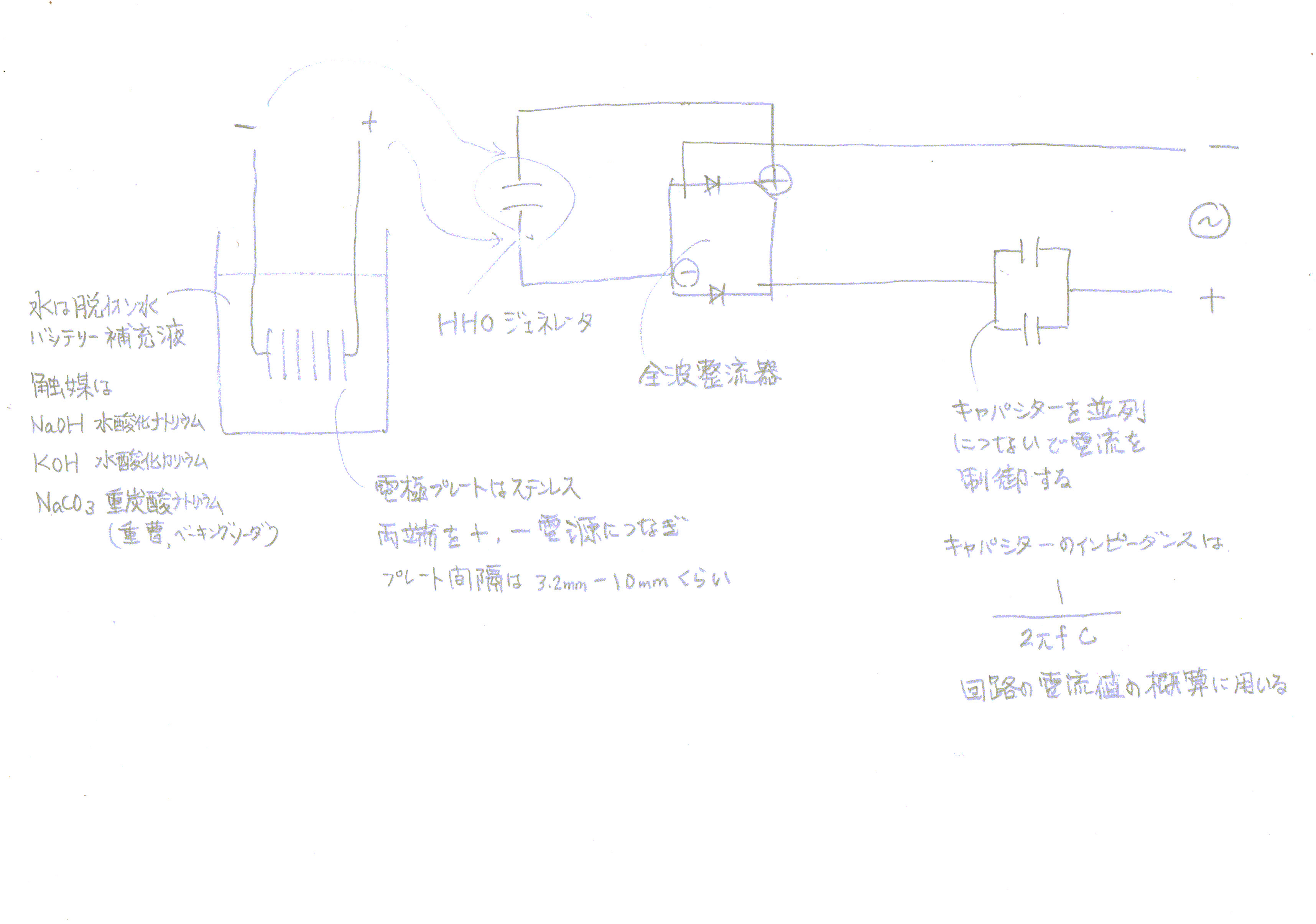
電解液
脱イオン水(バッテリー補充液)を用いる。
電解液の触媒に苛性ソーダを用いる。
水酸化ナトリウム(NaOH)、又は水酸化カリウム(KOH)
sodium hydroxide (lye) or potassium hydroxide
苛性ソーダを276mlの脱イオン水に少しずつ溶かし込み電解水を作る。
水酸化ナトリウムや水酸化カリウムは反応の激しい危険物なので注意深く少しずつ溶かし込みます。
溶液をこぼしたり、皮膚につけたりすることがないようにしてください。
万一こぼしたり、皮膚についたりしたら大量の水で洗い流してください。
重炭酸ナトリウム(NaOH3) 重曹
食塩(NaCl)
などを触媒に用いても良い。
ガス発生量は低くなるが苛性ソーダより安全で入手しやすい。
飲用水素水やガス吸入用のHHOガス発生装置を作るときに試してみると良いと思います。
常時監視状態で使用する爆発の危険のないレベルのガス発生量の装置を作る場合は、圧力制御装置などの安全装置は不要となりますので作りをより簡単にでき手軽に試してみる事ができます。
車の燃費改善用やガストーチ用の装置などの高負荷装置の場合は、触媒には苛性ソーダを用い、圧力制御装置など必要な安全装置を付けると良いと思います。
電極プレート
6枚のステンレス版を最低3.2mm間隔をあけて並べ電極とします。
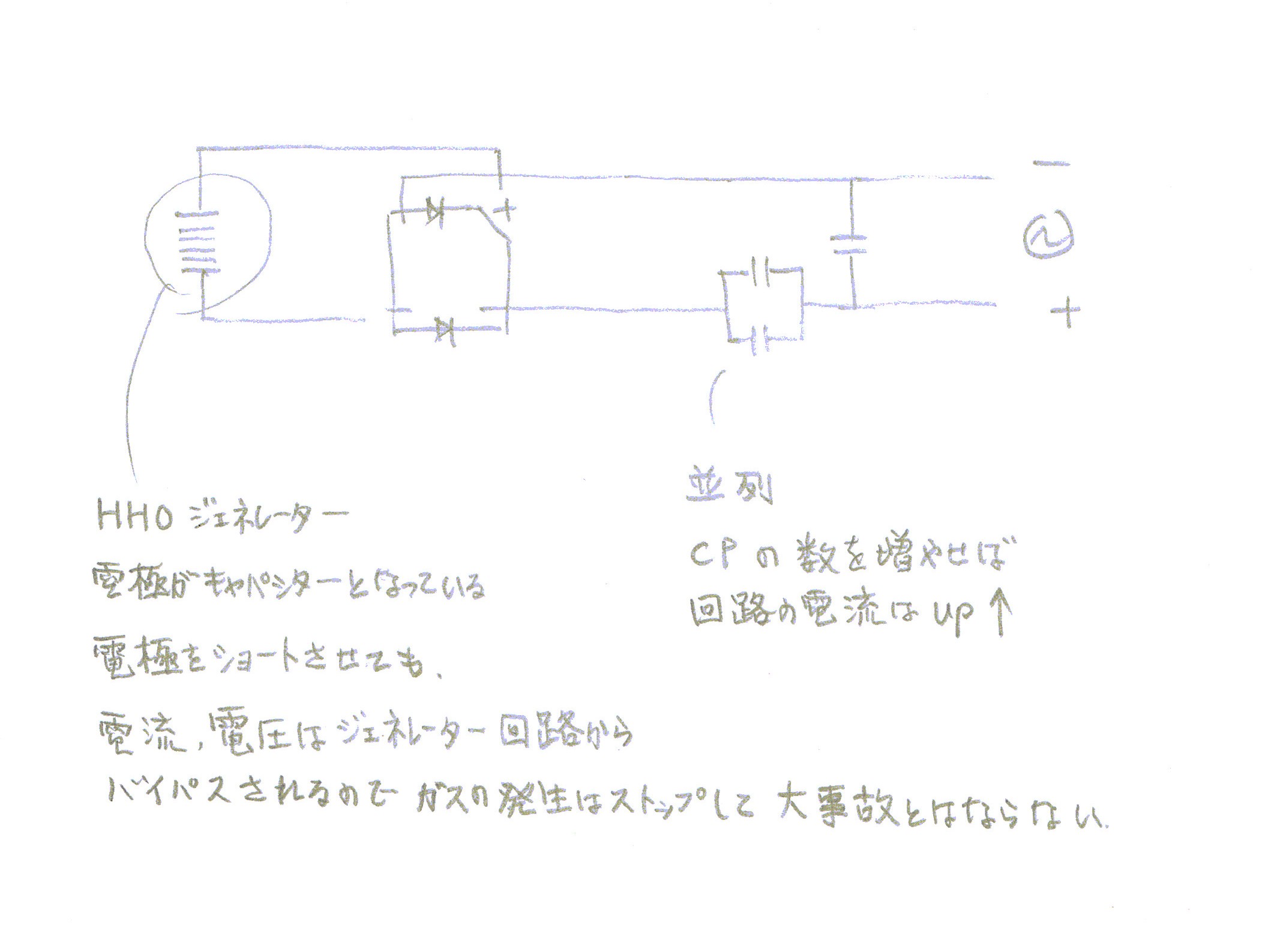
電極プレートは、両端が電源に接続されたキャパシターのようになっています。
プレートの間隔を広くすると電流を流すための電圧が余計に必要となります。
間隔を狭くするとプレート間の抵抗値は低くなります。
あまり狭くしずぎると、毛細管現象や発生ガスによる別の不具合が発生しますので、おおよそ3.2-10mmくらいで良いと思います。
直流電源用電流制御用キャパシター(コンデンサー)
120VACをキャパシターと整流器を用いてプレート電極の直流電圧電流を制御します。
電源電圧 120VAC 60Hz
全波整流器 (full wave bridge rectifier) 120パルスDCV
キャパシター 1A/24μF
キャパシターのインピーダンス 1/2πfC = 1/2*3.14*24μ = 111
回路電流 120/111 = 1A
キャパシターで電流、電圧を制御する利点
電極プレート電圧が電流値に応じて自動的に必要電圧に制御されるので電圧調整用トランスより優れている。
電極プレートがショートしても大電流は流れない。むしろ電流、電圧とも0に近づきガスの発生は止まるので爆発などの危険はない。
プレートに流す電流値を上げたければ、並列接続のキャパシターの数を増やせば良い。
キャパシターを並列接続するとインピーダンスは減り電流値が増えます。
電流値が高くなるほどガスの発生量は増えます。
交流電源を用いる場合、変圧器(トランス)よりキャパシターによる電流・電圧コントロールがベストと思います。
キャパシターによるバッテリー充電器は、サルフェーションで充電不能となったバッテリーでも充電可能です。
関心ある方はCapacitive Battery Chargerについて学んでください。
水 (H2O) について学ぶ
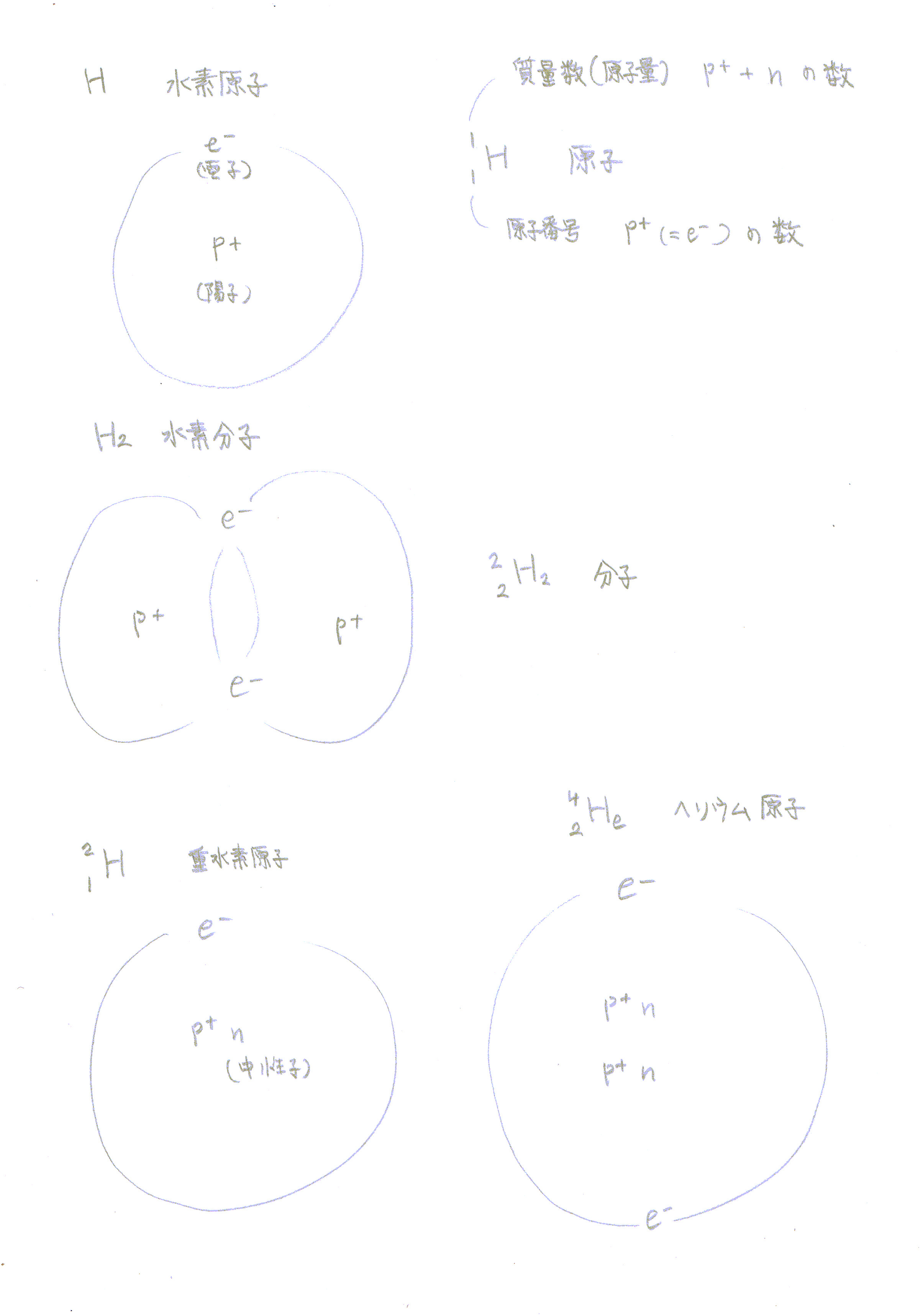
原子量
最初、原子量は原子の相対的な質量で一番軽い水素を基準に決められました。
陽子を1個だけ持つ水素が1で、他は陽子の数と中性子の数の合計の質量数となっています。
たとえば、酸素は陽子の数が8個、中性子の数が8個なので、酸素の質量数は16で原子量は16となります。
現在では、炭素の原子量12が基準となっています。
分子量
分子量は分子に含まれる原子の原子量の合計です。
たとえば、酸素分子 (O2) は酸素原子2つからなるので、酸素の分子量は、16 × 2 = 32 となります。
原子量12の炭素原子とつり合わせるためには、
12と32の最小公倍数から必要数を割り出します。
12と32の最小公倍数は96なので、
炭素の数は、96 ÷ 12 = 8個
酸素の数は、96 ÷ 32 = 3個
で原子量(重さ)が釣り合います。
つまり炭素原子8個と酸素分子3個は同じ重さになります。
原子量12の炭素原子1個は、原子量1の水素原子12個と重さが釣り合います。
原子量12の炭素原子1個と、原子量16の酸素原子を同じ重さにするためには、
炭素原子4個と酸素原子3個必要となります。
計算の仕方は、
12と16の最小公倍数を求めます。
12 = 4 × 3
16 = 4 × 4
最小公倍数は、4 × 3 × 4 = 48
原子量12の炭素の数は、48 ÷ 12 = 4個
原子量16の酸素の数は、48 ÷ 16 = 3個
で双方は同じ重さ (48g) になります。
原子量12の炭素は1モル(6.022*10^23個)で重さが12gとなります。
つまり、炭素のモル質量は、12g/molです。
モル質量とは、原子や分子を1モル(6.022*10^23個)にすると、その原子や分子の重さがその物質の原子量、あるいは分子量グラムになることを意味します。
では、原子量12の炭素が何モル集まると48gになるのでしょうか。
答えは、
48g ÷ 12g/mol = 4mol となります。
12g/molの炭素が4mol集まると48gとなります。
12g/ダースの鉛筆が4ダース集まると48gとなることと同じ考え方です。
1ダースは12本なので、4ダースの鉛筆の数は 4 × 12本 = 48本ということになります。
鉛筆1本の重さは、
48g ÷ 48本 = 1g/本 となります。
それは、12g/ダースなので、12g ÷ 12本 = 1g/本 と同じです。
水分子 (H2O) は、水素原子2個(あるいは水素分子1個)と酸素原子 (O) 1個からできており、
その分子量(原子量の総和)は、1 + 1 + 16 = 18 となります。
自然界では水素や酸素は単体原子(HやO)としてではなく、分子(H2やO2)の形で存在し、酸素もO2の分子の形で存在しています。
それで、水素(H2)と酸素(O2)が結合して化合物の水(H2O)を作るために、
水素分子(H2)は2モル、酸素分子(O2)は1モル必要で、化合物である水(H2O)は2モルできます。
2H2 + O2 = 2H2O
となります。
水素分子 (H2) が2モルあるということは、単体水素原子 (H) が4モルあることを意味します。
酸素分子 (O2) が1モルあるということは、単体酸素原子 (O) が2モルあることを意味します。
つまり、
4モルの水素原子(H H H H) と 2モルの酸素原子 (O O) で2モルの水分子 (2H2O) ができます。
それが、この式の意味です。
2H2 + O2 = 2H2O
では分子量を計算してみましょう。
分子量とは原子量の総数のことですから、
水素の原子量1
酸素の原子量16
水素原子 (H) が4モル、あるいは水素分子 (H2) が2モルで、
1 × 4、または、2 × 2 で、4g の水素
酸素原子 (O) が2モル、あるいは酸素分子 (O2) が1モルで、
16 × 2、または、32 × 1 で、32g の酸素
水素4gと酸素32gで、4g + 32g = 36g の水ができます。
この36gは、2モルの水分子 (2H2O) の重さです。
1モルの水分子の重さは、その半分の18gです。
仮に水素2gと酸素16gを用いて水18gを作るとすると、
水素分子 (H2) 1モルと、酸素分子 (O2) 1/2モルを使うことになります。
これを化学反応式を書くとすると、
H2 + 1/2(O2) = H2O となります。
意味は、水素分子 (H2) 1モル(2g) と、酸素分子 (O2) 1/2モル (16g) で、水分子 (H2O) 1モル (18g) と言うことです。
原子や分子について
原子や分子の数を扱うための単位には「モル」が使われます。
1モルは、6.022*10^23個のことです。
陽子の数6.022*10^23個(1モル)で、その重さは1.008gとなります。
中性子の数6.022*10^23個(1モル)で、その重さは0.99187gとなります。
1個の陽子の重さは、
1.008gmol ÷ 6.022*10^23個 = 1.67*10^-24g/1個
この1.67*10^-24gは、単体水素原子 (H) mon-atomic hydrogen 1個の重さのことです。
単体水素原子 (H) mon-atomic hydrogenは、
陽子 1個 1.67*10^-24g
電子 1個 陽子の1/1840gで、ほとんど質量がないので無視
で構成されています。
単体水素 (H) monatomic hydrogen 1モル(6.022*10^23個)の重さは、1.008g/molです。
二原子水素 (H2) diatomic hydrogen は、 H (monatomic)が結合して H2(水素分子)となっています。
水素は通常(H2分子)として存在しています。
水素分子 (H2) の濃度は、0.00009g/ml
水素分子 (H2) diatomic hydrogen 1モル(6.022*10^23個)の重さは、2.016g/mol (1.008g/mol × 2)
水素分子 (H2) diatomic hydrogen 1個の重さは、
2.016g/6.022*10^23 = 3.35*10^-24g/1個
水素分子 (H2) diatomic hydrogen 1個の体積は、
3.35*10^-24g/0.00009 = 3.722*10^-20ml/1個
水素分子 (H2) diatomic hydrogen 1モル(6.022*10^23個)の体積は、
3.722*10^-20ml × 6.022*10^23個 = 22413.884m/lmol (22.4L/mol)
また、
2.016g/mol ÷ 0.00009g/ml = 22400m1/mol (22.4L/mol)
陽子1個と電子1個の単体水素 (H) monatomic hydrogen はすべての物質の最小構成要素とります。
物質の性質の違いは、その物質が持つ陽子と電子の数の違いから生じます。
水素の単体原子 (H) の気体の体積は、0℃、1気圧下で、22.4L/molとなります。
気体の体積は、温度、圧力で変わります。
同温、同圧下で同体積の気体は、分子の種類に関係なく、同じ数の分子(同じモル数)となります。
1モルの気体の体積は、気体の種類に関係なく22.4Lとなります。
| 物質 | 1モルの体積 (L) | 1モルの質量 (g/mol) |
|---|---|---|
| H | 22.4L | 1g |
| H2 | 22.4L | 2g |
| O | 22.4L | 16g |
| O2 | 22.4L | 32g |
水素原子は、密度が一番小さく軽いので浮くわけです。
水 (H2O)
水素(H)と酸素(O)の化合物
質量数とは陽子と中性子合計数、原子量とも表現される。
原子量は実際の重さではなく、実際の重さを得るための重さの比です。
原子の実際の重さは、原子量を6.022*10^23個(1モルの数)で割って算出します。
Hの質量数(原子量) 1(陽子1個だけ中性子はない)
Oの質量数(原子量) 16(陽子8個、中性子8個)
陽子のモル質量は、 1.008g/mol(1モルで1.008gという意味)
中性子のモル質量は、0.99187g/mol(1モルで0.99187gという意味)
Hのモル質量は陽子1個だけなので、陽子と同じで1.008g/mol(1モルで1.008gという意味)
水素原子 (H) 1個の実際の重さは、1.008g ÷ 6.022*10^23個(1モル)= 1.67*10^-24g
Oのモル質量は陽子8個と中性子8個で、(1.008 + 0.99187) × 8 = 15.99896g/mol(1モルで15.99gという意味)
酸素原子 (O) 1個の実際の重さは、15.99g ÷ 6.022*10^23個(1モル)= 2.65*10^-23g
水の分子 (H2O) のモル質量は、
H + H + O = 1.008 + 1.008 + 15.999 = 18.015g/mol(水の分子は1モル(6.022*10^23個)で18.015gという意味)
つまり、18gの水は、水分子 (H2O) を6.022*10^23個含んでいるということです。
その内わけは、水素分子 (H2) 6.022*10^23個(1モル)と、酸素分子 (O2) 3.011*10^23個(1/2モル)からできています。
H2 + 1/2(O2) = H2O 通常はこのように表記せずに、
2H2 + O2 = 2H2O と書きます。
意味は、水素分子 (H2) 2モルと、酸素分子 (O2) 1モルで水の分子 (H2O) が2モルできるという意味です。
とりあえず、先にあげた「H2 + 1/2(O2) = H2O」を使って説明します。
水素分子の体積は、1モルなので、22.4L
酸素分子体積は、1/2モルなので、11.2L
水素分子と酸素分子の合計体積は33.6Lとなります。
18gの水をすべて電気分解して33.6Lの気体が生じたら、それは水素分子 (H2) と酸素分子 (O2) の混合ガスだということです。通常この水素分子と酸素分子の混合ガスが発生します。この分子の混合ガスはブラウンガス(HHOガス)ではありません。
では、18gの水をすべて電気分解し水素原子 (H) と酸素原子 (O) を発生させるとどうなるでしょうか。
H2Oを原子の組み合わせでみると、水素原子 (H) 2モル(2 × 6.022*10^23個)と、酸素原子 (O) 1モル(6.022*10^23個)です。
H + H + O = H2O
水素原子の体積は、2モルなので、44.8L
酸素原子体積は、1モルなので、22.4L
水素原子と酸素原子の合計体積は67.2Lとなります。
18gの水をすべて電気分解して67.2Lの気体が生じたら、それは水素原子 (H) と酸素原子 (O) の混合ガスだということです。この原子の混合ガスがブラウンガス(HHOガス)です。
電気について
ファラデーの発見
電気分解に用いる触媒
溶解熱について
原子の結合エネルギー (bond energy/mol)
ガストーチの燃焼について
ファラデーの発見
マイケル・ファラデー (Michael Faraday) は水の電気分解の実験をとおして2つの大切な法則を発見しています。
1 電極で分離する粒子の重さは、電流の量に比例する。
2 異なる電解液にとおす同じ量の電流で分離する粒子の重さは対応する。
1Faraday(ファラデー) = 96,500q(クーロン)
1A = q/sec
1Faraday = 26.8A/h (1時間は3,600secなので、96,500q/3,600sec)
1ファラデーは、使用電圧に関係なく26.8A/hで水の電気分解を起こし陰極(cathode) に1gの水素(H2 or H) を発生させる電流です。
分子の発生量
電解液に1ファラデー (26.8A/h) の電流が流れると電気分解が生じ、陰極 (cathode) に1gの水素分子 (H2)、陽極 (anode) に8gの酸素分子 (O2)が発生します。
電圧は直接関係しません。
電極間に電流を流すのに必要な電圧だけで十分です。
不必要な電圧は電力の浪費となり、効率の悪い発生装置となります。
理論値として1.23Vの電圧で十分とみなされています。
水素分子 (H2) のモル質量は、2g/mol なので、1g の水素分子 (H2) は、1/2モル (11.2L) 陰極に発生します。
酸素分子 (O2) のモル質量は、32g/mol なので、8g の酸素分子 (O2) は、1/4モル (5.6.2L) 陽極に発生します。
1モルの水 (H2O) 18g/mol を1ファラデー (26.8A/h) の電流で電気分解すると、
水 (18g) ⇒ 水素 (1g) + 酸素 (8g)
H2O (18g/mol) ⇒ 1/2H2 (1g) + 1/4O2 (8g)
水素分子 (H2) 1/2モル (1g) が陰極に生じ、酸素分子 (O2) 1/4モル(8g) が陽極に生じるということを意味しています。
発生気体の体積は、水素分子 (H2) が11.2L (1/2 × 22.4)、酸素分子 (O2) が5.6L (1/4 × 22.4)で、総計は16.8Lとなります。
この水素分子 (H2) と酸素分子 (O2) の16.8Lの混合気体はブラウンガス(HHOガス)ではありません。
原子の発生量
水素原子のモル質量は、1g/mol
酸素原子のモル質量は、16g/mol
1gの水素原子 (H) は1モル、8gの酸素原子 (O) は1/2モルとなります。
1モルの水 (H2O) 18g/mol を1ファラデー (26.8A/h) の電流で電気分解すると、
水 (18g) ⇒ 水素 (1g) + 酸素 (8g)
H2O (18g/mol) ⇒ H (1g) + 1/2O (8g)
水素原子 (H) 1モル (1g) が陰極に生じ、酸素原子 (O) 1/2モル(8g) が陽極に生じるということを意味しています。
発生気体の体積は、水素原子 (H) が22.4L (1モル)、酸素原子 (O) が11.2L (1/2 × 22.4)で、総計は33.6Lとなります。
この発生ガスは、HHOガス(ブラウンガス)です。
ブラウンガスは、分子の水素と酸素ではなく、原子の水素と酸素の混合気体となり、体積は分子の混合気体の2倍の33.6Lとなります。
交流電源(AC電源)で水を分解すると、通常、分子の水素と酸素が発生します。
原子の水素と酸素を発生させるためには、直流電源を(DC電源)を用います。
電気分解に用いる触媒
水酸化ナトリウム NaOH (Sodium Hydroxide)
水酸化カリウム KOH (Potassium Hydroxide)
重炭酸ナトリウム NaHCO3(重曹、ベーキングソーダ)(Sodium Bicarbonate)
など
カリウム (K) やナトリウム (Na) はイオン化傾向が大きい。(つまりイオンになりやすい)
水酸化ナトリウムの触媒を水に溶かした電解液は陽イオンと陰イオンを含んでいます。
NaOHは、ナトリウムイオンと水酸イオン (Na+とOH-)になり、
H2Oは、電圧がかかると水素イオンと水酸イオン (H+とHO-)になります。
+イオン(陽イオン)のことをカチオン (cation)
-イオン(陰イオン)のことをアニオン (anion)
と呼びます。
陰極 (Cathode) から電子 (e-) が電解液に供給されると、
水素イオン (H+) は陰極の電子 (e-) を得て水素原子 (H) となります。
それで、陰極に水素が発生します。
水酸イオンは (OH-) は陽極で電子 (e-) を離して酸素原子 (O) と水素イオン (H+) に別れます。
酸素イオン (O-) も同様に陽極で電子 (e-) を離して酸素原子 (O) となります。
それで、陽極に酸素が発生します。
これは、電気分解の大まかな概要です。
現実には、知り得ないもっと複雑な事が生じていると思います。
直流電源を使った電気分解では、
陰極で電子 (e-) が与えられ、陽極で電子 (e-) が取りされられます。
電子を得ることを還元と呼び、電子を奪われることを酸化と呼びます。
陰極で水素イオンは還元され水素原子となります。H+ + e- = H
水素原子は結合して水素分子となります。H + H = H2
陽極で酸素イオンは酸化され酸素原子となります。O2- - 2e- = O
酸素原子は結合して酸素分子となります。O + O = O2
電子の流れを追うと、電子は陰極 (cathode) から入り陰極で電子を受取るイオンは還元されることになり、また陽極 (anode) から出て行き、陽極で電子を失うイオンは酸化されることになります。
陰極と陽極の間では、電子の流れをつくる複雑な化学反応が起きています。
結果として、陰極で水素、陽極で酸素が発生します。
水素や酸素の分子 (H2, O2) を発生させるのではなく、水素や酸素の原子(H, O) を発生させると有益です。
溶解熱について
物質を水に溶かすと発熱、または吸熱反応が生じます。
水酸化ナトリウムや水酸化カリウムを水に溶かすと、発熱反応が生じ容器温かくなります。
一方、クエン酸の場合は吸熱反応が生じて容器は冷たくなります。
分子がイオンに分解するときにはエネルギーを必要とし、周りから熱(エネルギー)を奪うために吸熱反応が生じます。
分子が水に解けるときは、溶媒の分子が分解してイオンとなり、周りから熱を奪う吸熱反応が生じ、その後イオンが水の分子と電気的に結びついて溶液中に均一に拡散します。
イオンが水の分子と結合するときは、余分の熱を開放するため発熱反応となります。
この分解と結合の吸熱と発熱反応の総和で、全体として発熱反応になるのか、吸熱反応になるかが決まります。
物質の持つ特有の結合力や構造のために、また分解の過程と結合の過程が異なるために、吸熱、発熱が生じ、またその程度が決まります。
分子が単に水に溶けて水和することと電気的に分裂することは別の現象ですが、分解の場合は吸熱、結合の場合は発熱となりエネルギーの出入りが生じ、最終結果は分解と結合のエネルギーの出入りの総和で決まります。
触媒を使わず水だけの場合の水の電気分解に必要なエネルギー大きくなります。
つまり、高電圧、高電流が必要となります。
イオン化傾向の高いカリウム (K) やナトリウム (Na) の触媒を使うと低エネルギー(低電圧、低電流)で水を電気分解できます。
電圧がかかると、電解液中の水酸化ナトリウム (NaOH) は、ナトリウムイオン (Na+) と水酸イオン (OH-) に分かれます。このときの反応は吸熱反応となります。
ナトリウムイオン (Na+) は水 (H2O) と非常に激しく反応します。
ナトリウムイオンは水を酸化し、つまり電子を奪い水を分解し、水酸イオンと再結合して水酸化ナトリウム戻り、水素をガスを発生させます。
Na+ + OH- + H
金属のナトリウムは、空気中の水分とも激しく反応し水素ガスを発生させます。(要注意)
触媒の入った水溶液を電気分解すると、
分子の分解、結合、再分解、再結合などの複雑な反応が連続的に続きエネルギーの総和で発熱、吸熱反応が生じ、また水素、酸素ガスが発生します。
その際の熱量やガスの発生量は、電流、触媒の分子構造に依存します。
原子の結合エネルギー (bond energy/mol)
原子の結合、分解エネルギー
H2 (H-H) 104.2 kcal/mol
O2 (O-O) 118.3 kcal/mol
OH (O-H) 101.5 kcal/mol
H2O (H-OH) 119.7 kcal/mol
1モルの水分子 (H2O) を分解させるのに必要なエネルギーは、
H-OH 119.7
O-H 101.5
計 221.2 kcal/mol
水素分子 (H2) と酸素分子 (O2) を結合させて水 (H2O) をつくのに必要なエネルギーは、
2H2 + O2 = 2H2O
2モルの水素分子 + 1モルの酸素分子 = 2モルの水分子
水素原子と酸素原子の結合エネルギーは、
H2 (H-H) 104.2 kcal/mol
O2 (O-O) 118.3 kcal/mol
2モルの水分子の結合エネルギーは、
2H2 (2 × 104.2) + O2 (118.3) = 326.7 kcal
水分子 (H2O) 1モルを分解するとき必要なエネルギーが221.2 kcal/molですから、2モルの水分子 (H2O) を分解させるのに必要なエネルギーは、2 × 221.2 = 442.4 kcal
水の電気分解のときには、この分解に必要なエネルギー 442.4 kcal は熱としてではなく電気エネルギーとして加えられ水を水素と酸素に分解します。
2モルの水素分子 (2H2) と1モルの酸素分子 (O2) を結合させて2モルの水分子 (2H2O) をつくるのに必要なエネルギーは、326.7 kcal
2モルの水分子 (2H2O) を分解するときに得たエネルギーは、442.4 kcal ですから、バラバラになっている水素原子 (H) と酸素原子 (O) が再結合して2モルの水 (H2O) をとなると、分解の際に得た 442.4 kcal から再結合に必要な 326.7 kcal を差し引いた、115.7 kcal が余分なエネルギーとして残り、この分が熱として放出されます。
この余分のエネルギーが原因で水の電気分解は発熱反応となります。
水の電気分解では、加えられた電機エネルギーと、発生した熱エネルギーも利用され、分解と再結合が複雑に続き水素ガスと酸素ガスを発生します。
1モルの水分子 (H2O) にすると、
115.7 ÷ 2 = 57.85 kcal/mol
水1モルの重さは、18gなので、
水1g当たりの発熱量は、57.85 ÷ 18 = 3.2 kcal/g
3.2 kcal/g は、1Lの水の温度を3.2℃上げる熱量です。
この3.2 kcal/g は、水素原子 (H) と酸素原子 (O) が生成されて再結合で1モルの水になった場合の熱量です。
ガストーチの燃焼について
通常は、水素分子 (H2) と酸素分子 (O2) のガスが燃焼します。
ガストーチの水素分子 (H2) と酸素分子 (O2) は、まず水素原子 (H) と酸素原子 (O) に分解し、その後結合(燃焼)して水 (H2O) となります。
2モル水素分子 (2H2) と酸素分子 (O2) の結合(燃焼)で要する熱は、326.7 kcal
2H2 H-H 104.2 kcal/mol × 2 = 208.4 kcal
O2 O-O 118.3 kcal
2モル水素分子 (2H2) と酸素分子 (O2) が結合(燃焼)して2モルの水分子 (2H2O) になるときに、115.7 kcal の熱が発生します。この熱は分解と結合の自己反応に用いられれガスは燃焼をつづけ反応生成物として水ができます。
水素分子と酸素分子のガスの燃焼温度は約2800℃です。
1モルの水分子 (H2O) は、57.85 kcal/mol のエネルギーを持っています。
水蒸気は、さらに 10.45 kcal の潜熱を持っています。
ブラウンガスの特性 (Properties of Brown's Gas)
水の電気分解のプロセスの復習
水の分子は、電気エネルギーにより陽イオン (cations) と陰イオン (anions) に分解しまし、電子の受け渡しにより単体原子 (mon-atomic) の水素 (H) と酸素 (O) になります。この過程ではエネルギーは熱の形ではなく電気で供給されるので吸熱反応はなく電解液の温度は変わりません。
次に、通常各原子の大半は結合して分子を作り、水素分子 (H2) と酸素分子 (O2) となります。この過程で熱が発生します。
多くの水素原子 (H)、および酸素原子 (O) が結合せずそのまま残ると、結合による熱の発生量は抑えられます。
ブラウンガス (HHOガス) は単体原子 (mon-atomic) のガスですから、通常の分子 (di-atomic) のガスより発生熱量が低くなります。
また、単体原子の1モル当たりの体積は、分子の1モル当たりの体積より大きくなります。
水素原子 (H) の1モルは水素分子 (H2) の1モルの体積の2倍となります。
酸素も同様に2倍となります。 酸素原子 (O)、 酸素分子 (O2)
2モルの水分子 (2H2O) が2モルの水素分子 (2H2) と1モルの酸素分子 (O2) になると、
発生ガスの体積は、67.2L となります。(2 × 22.4 + 22.4 = 37.2)
もし、水素原子と酸素原子がそのまま残り分子をつくらない場合は、
発生ガス(non-atomicガス)の体積は、134.4L となります。(4 × 22.4 + 2 × 22.4 = 134.4)
ユル・ブラウン (Yull Brown) のガス発生装置は、340L/kwh のガスを発生させたと報告されています。
1ファラデー = 26.8A
2.1VDC電源
26.8 × 2.1 = 56.28w
56.28wh の電力で19LのHHOガスを発生させたということ。
1kwh ÷ 56.28wh = 17.76
340L ÷ 17.76L = 19L
オーストラリア国鉄の研究所の所長ハラルド・ヘニュッシュ (Harald Hanisch) は、ブラウンのガス発生装置の追試を行い 368/kwh のHHOガスの生成を確認しています。
1Lの水で通常の水素・酸素分子の混合ガスの2倍の1866.6LのHHOガスが得られます。
ブラウンガス(HHOガス)の燃焼
HHOガスの燃焼は、水素や酸素が原子のままで分子への結合がない分発熱がなく、その炎の温度は通常の水素分子と酸素分子の混合ガスの炎より格段に低くなります。
また、HHOガスは燃焼して水に戻ります。
その際の体積の比は、1866:1となり、水に戻ると堆積が1/1866となります。
つまり、HHOガスは爆発ではなく爆縮します。
容器に溜めたHHOガスに点火すると爆縮し容器内は真空となり容器はつぶれ中に水が残ります。
水素原子と酸素原子が結合して燃焼して2モルの水になるときに出る熱量は、442.4kcalとなります。
水素原子の構造(万物の元となる1個の陽子と1個の電子)や、ガスの燃焼の際の爆縮の影響(真空を作り出す)など未知のメカニズムにより、ブランガス(HHOガス)を用いると、以下の興味深い現象が生じます。
HHOガスの炎の温度は空気中では129-137℃くらなのにタングステンに当てると6000℃でタングステンを溶かすことができる。対象物に合わせて温度が変わります。(物質の持つHとOをオフセットしてると思われる)
木材、金属、セラミックにレーザーで開けたようなシャープな穴を開けられる。
異なる物質の融合ができる。(物質に応じて異なる溶解温度が生じる)
放射能を消し去ることができる。
物理学で認識され始めている事実は、万物の最小ユニットである陽子、中性子、電子が、空間に現れたり消えたりし続けていることです。つまり空間はエネルギーで満ちています。
そのエネルギーを取り出すひとつの方法がHHOガスであるということです。
HHOガスの水素原子と酸素原子の比率は、2:1 です。
原子が再結合して分子に戻らないようにする必要があります。
水素原子は最小の物質であるために容器に長期にわたり溜め置きができません。
すぐに大気中に拡散し、酸素など他の物質と再結合してゆきます。
HHOガスは、水の電気分解装置でオンデマンドで生成してその場で使うことが最も実際的な使い方となります。
HHOガスを通した水もその日のうちに飲なまいとただの水となります。
HHOガスをカニューラで吸うのもオンデマンドでガスを発生させて行います。
HHOガスを金属や石の溶接、切断、加工に使う場合も、車のエンジンに送り込む場合も直流電源でHHOジェネレータを動かしてオンデマンド行います。
イーグル・リサーチのBROWN'S GAS資料
HHOガスのジェネレータの作り方は、イーグル・リサーチや、その他ネットを検索して調べてください。




